卒業研究のご紹介
2022年版
化学・バイオ系所属学生
熱ストレスにより誘導されるシャペロニン翻訳後修飾と反応調節機構の解析
義原 千花歩神奈川県
大学院応用化学・バイオサイエンス専攻Bコース 博士前期課程
2022年3月修了
(応用バイオ科学部応用バイオ科学科 医生命科学特別専攻 2020年3月卒業)
2022年3月修了
(応用バイオ科学部応用バイオ科学科 医生命科学特別専攻 2020年3月卒業)
神奈川県立平塚中等教育学校出身
研究の目的
熱などのストレスで変性したタンパク質は、機能を失うだけでなく、凝集し細胞毒性を示す。熱ストレスに応答して発現誘導されるシャペロニンGroEL/GroESは、細胞内の変性タンパク質を結合して凝集を抑制し、構造形成して再生する機能をもつ。これまで研究室では、細胞への熱ストレスが発現誘導に加えてシャペロニンのリン酸化(翻訳後修飾)を誘導することを見出したため、本研究ではシャペロニンのリン酸化を行うプロテインキナーゼ(PK)を特定し、リン酸化による反応調節機構を明らかにすることを目的とした。
研究内容や成果等
■ 方法
大腸菌K12株に存在するPKを6種類選定し、発現ベクターを作製した。作製した発現ベクターを組換えた菌体とPK欠損株を37/46℃で培養後、GroELを精製しリン酸化ペプチドを質量分析(LC-MS/MS)で解析することでリン酸化部位を同定し比較した。さらに、各リン酸化部位がGroELの構造に与える影響を検討するために、GroEL/GroES複合体についてリン酸化が同定されたアミノ酸残基にリン酸基を付加し、27/60/80℃の温度条件で分子動力学(MD)シミュレーションを行った。
■ 結果および考察
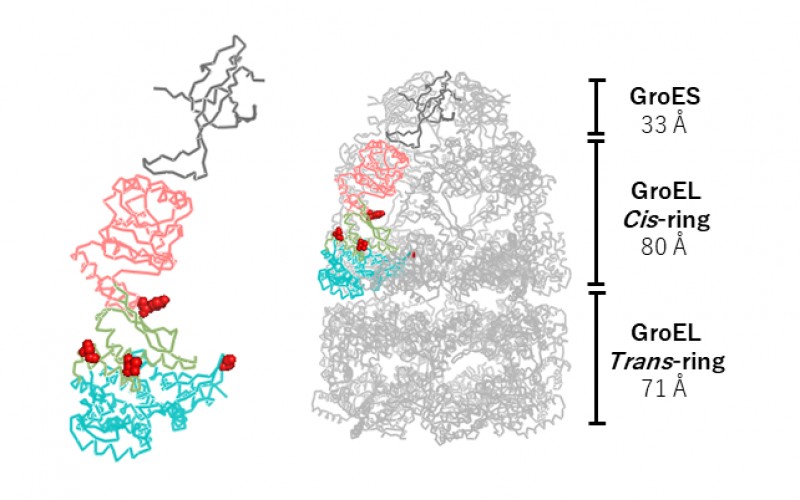
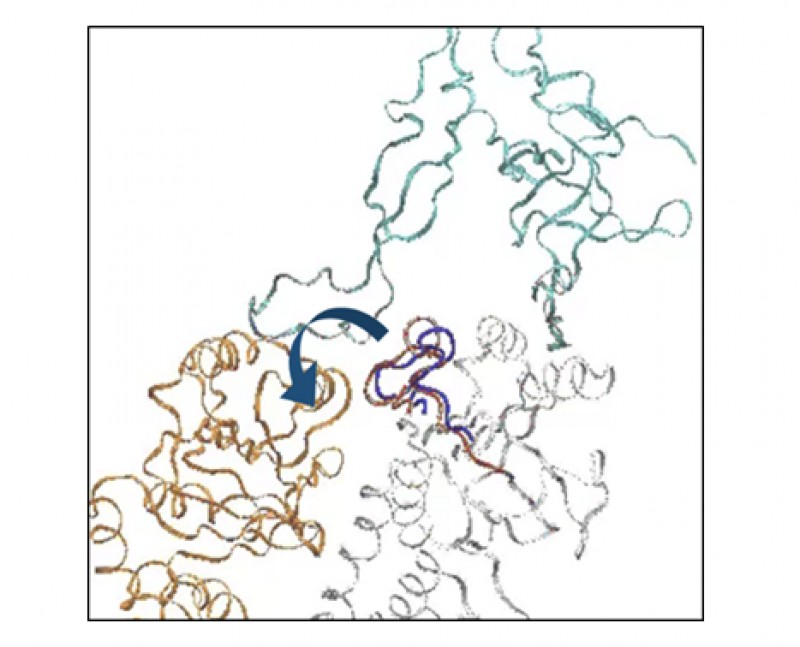
精製したGroEL(37、46℃培養)、PK欠損株およびPK強制発現株から精製したGroEL(37℃培養)からリン酸化が検出された。また、PKを強制発現株から精製したGroEL(46℃培養)から新たにリン酸化を2箇所検出した(図1)。この結果から、熱ストレスでリン酸化部位が増加し、どのPKがGroELのどの部位をリン酸化するか明らかになった。またMDシミュレーションのRMSD値を解析した結果、これらのリン酸化はGroELのループの動きを変化させ(図2)、リン酸化がGroELの基質結合特性に関わる可能性を示した。



研究活動を振り返り成長したこと
結果を正しく報告し相談する方法、プレゼンテーションの作り方や心構えなどの基本的なスキルだけでなく、論理的に考える力が身についたと思います。私は目の前の事象を1つの方向だけで考えてしまう傾向があり、実験が上手くいかないときの抜け出し方がわかりませんでした。小池先生に『上からも下からも』考え、データを確実に積み重ねていく方法を学んだことで、実験成果が得られただけでなく、自信もつきました。 もともとは消極的に物事を捉えてしまう性格でしたが、自ら考え行動を起こすことで良い結果を引き寄せられることを学会での受賞なども経験して学ぶことができました。これからも研究室で得た経験を活かして、前のめりで頑張りたいと思います。