卒業研究のご紹介
2019年版
化学・バイオ・栄養系所属学生
ストレスで誘因されるシャペロニン翻訳後修飾と活性調節機構の解析
岩田 友佑埼玉県
応用バイオ科学部応用バイオ科学科 2019年3月卒業
東京工業大学附属科学技術高等学校出身
研究の目的
タンパク質の翻訳後修飾は、タンパク質機能の調節や細胞全体のシグナル伝達において主要なメカニズムを担っている。我々の研究しているシャペロニンは、熱などのストレスで細胞内のタンパク質が変性した際に、それらを保護し再生する機能を持つタンパク質である。最近の研究で、シャペロニンのアミノ酸残基上での可逆的リン酸化が、細胞内の状況に応じたシャペロニン活性の調節をしている可能性が分かってきた。細胞への熱ストレスがシャペロニンのリン酸化を誘因するメカニズムを明らかにし、可逆的リン酸化によるシャペロニン活性の調節機構を解明することを目指している。
研究内容や成果等
■ 結果および考察
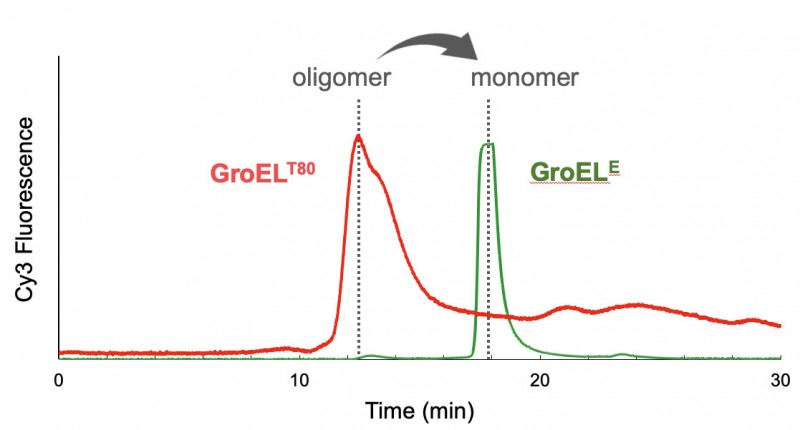
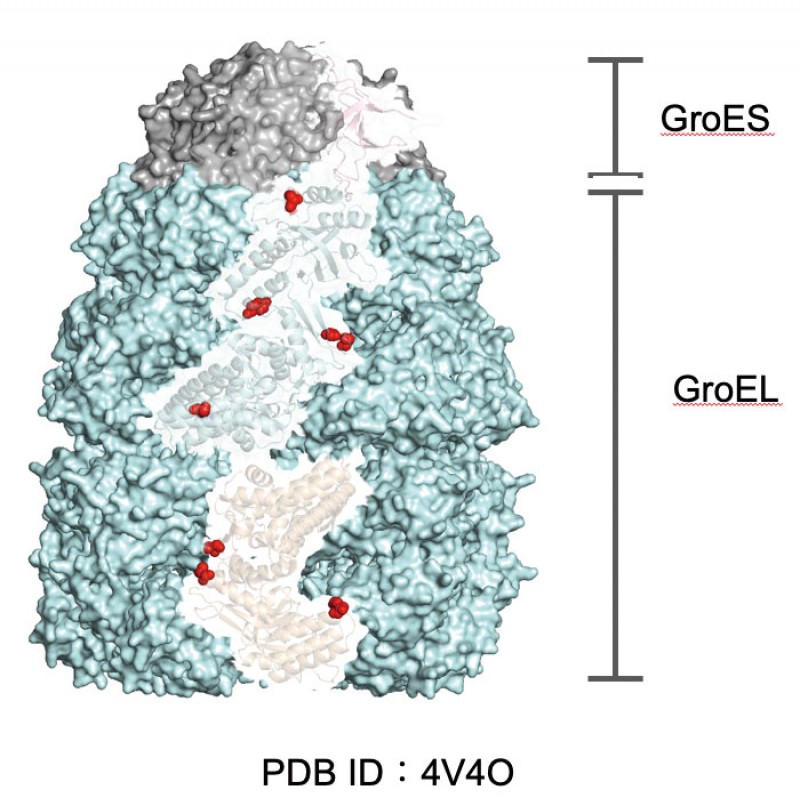
シャペロニンが機能するためには、14量体構造のGroELが、ATPとGroESを結合して複合体を形成することが必要である。高度好熱性細菌Thermus thermophilusから精製したGroELTは14量体構造を安定に維持できるが、組換え大腸菌で遺伝子を発現させて精製したGroELEはモノマーに解離し、14量体構造を維持できない(図1)。ATPとGroESを共存させると GroELEのオリゴマー形成能が少し改善するが、GroELTの安定性には及ばなかった。そこで、GroELTとGroELEを質量分析(LC-MS/MS)によって解析した。80℃で培養した T. thermophilusから精製したGroELT80では、合計8ヶ所のリン酸化が検出されたが、GroELEでは、リン酸化は1つも検出されなかった。リン酸化部位の多くは、14量体構造のサブユニット間に位置していたことから(図2)、GroELのリン酸化はオリゴマーの安定性に寄与していると考えている。
-
 指導教員からのコメント
教授 小池 あゆみ
指導教員からのコメント
教授 小池 あゆみ
- 細胞外からの刺激(ストレス)が原因で細胞内のタンパク質が化学的な修飾を受け、適切な活性をもつように制御されているという仕組みは、生物の巧みさを感じます。高度な分析技術の発展により、近年このような制御機構が次々と網羅的に解析され始めており、競争が激しい研究領域となっています。生物が、変性タンパク質を再生するシャペロニンをストレスに応答してどのように活性化するのかを解明することは、それができないために起こる病気の治療や予防に重要な知見をもたらします。岩田君は持ち前の判断力と機動力を研究に活かし、4年生ながら学会発表に至るまで研究を進展させてくれました。
-
 卒業研究学生からの一言
岩田 友佑
卒業研究学生からの一言
岩田 友佑
- 本学での研究活動を通して、論理的に考えることの重要性を学びました。研究をするうえで、参考論文をもとに実験を計画することが多々ありますが、実験操作の原理や操作を徹底的に理解していないと読み取ることさえできず、教科書をただ覚えるような表面だけの勉強とはまるで別物であることを実感しました。また、厳しい研究環境で活動することで、今まで知らなかった私自身の弱点を見つけることができました。私は特に大雑把な面が原因で実験結果に影響が出ることが多く、卒業研究の終盤では緻密な研究を心がけて行動するようになりました。研究を通して、社会に出ても恥じることのないスキルを身につけられました。
- 応用バイオ科学部応用バイオ科学科(大学サイト )
- 教員紹介ページ(大学サイト )
- 研究室ナビ(大学サイト)


