卒業研究のご紹介
2019年版
化学・バイオ・栄養系所属学生
がん細胞にアポトーシスを誘導する化合物の探索
城本 春菜神奈川県
応用バイオ科学部応用バイオ科学科 2019年3月卒業
神奈川県立横浜桜陽高等学校出身
研究の目的
多くのがん細胞ではアポトーシス機能が抑制されており、無限に増殖し浸潤や転移等の悪影響を及ぼす一因となっている。SurvivinはIAP(inhibitor of apoptosis protein)ファミリーに属するタンパク質で、IAPファミリーの特徴であるBIR(baculovirus IAP repeat)ドメインを1つ持つ。がん細胞では、この BIRドメインにおいてSurvivinとHBXIPが相互作用し、複合体を形成することによってアポトーシスを抑制することが知られている。そこでSurvivinとHBXIPの複合体形成を阻害することによって副作用の小さな抗がん剤の開発へ結びつけることができると考える。
本研究の目的は酵母ツーハイブリッド法を利用し、アポトーシスを誘導する生薬を探索することである。
本研究の目的は酵母ツーハイブリッド法を利用し、アポトーシスを誘導する生薬を探索することである。
研究内容や成果等
■ 実験方法
●生薬スクリーニング
SurvivinとHBXIPのベクターを導入した形質転換体酵母を用いて、スクリーニングを行った。実験方法としては5mLのSC-Leu,-Trp,-His液体培地で形質転換酵母を24h培養した。培養した菌液を5mLのSC-Leu,-Trp,-His液体培地に加え、25時間培養した。培養した菌液に生薬抽出物を終濃度100μg/mLになるように添加し、12時間暴露した。培養した菌液を集菌、洗浄を行い、ONPG溶液を加え、30℃で加温して30分間反応させた。その後、反応を停止し、吸光度を測定して、酵素活性を算出した。
●アポトーシス誘導確認 TUNEL染色
アポトーシス誘導の確認のためにTUNEL染色を行った。実験方法としては、培養した細胞を24ウェルプレートに継代を行い、24h培養した。生薬(紫根)を終濃度150、100、75、50、25μg/mLになるように添加し、24h培養した。培養後、トリプシン処理を行い、TdT enzymeとLabeling Safe Bufferで染色を行い、対比染色としてPIを滴下して観察を行った。
SurvivinとHBXIPのベクターを導入した形質転換体酵母を用いて、スクリーニングを行った。実験方法としては5mLのSC-Leu,-Trp,-His液体培地で形質転換酵母を24h培養した。培養した菌液を5mLのSC-Leu,-Trp,-His液体培地に加え、25時間培養した。培養した菌液に生薬抽出物を終濃度100μg/mLになるように添加し、12時間暴露した。培養した菌液を集菌、洗浄を行い、ONPG溶液を加え、30℃で加温して30分間反応させた。その後、反応を停止し、吸光度を測定して、酵素活性を算出した。
●アポトーシス誘導確認 TUNEL染色
アポトーシス誘導の確認のためにTUNEL染色を行った。実験方法としては、培養した細胞を24ウェルプレートに継代を行い、24h培養した。生薬(紫根)を終濃度150、100、75、50、25μg/mLになるように添加し、24h培養した。培養後、トリプシン処理を行い、TdT enzymeとLabeling Safe Bufferで染色を行い、対比染色としてPIを滴下して観察を行った。
■ 実験結果および考察
●生薬スクリーニング
構築した酵母ツーハイブリットシステムを用いて、生薬135種類の抽出物に対するスクリーニングを行った。その結果、生薬を添加せずに培養した菌液のβ-galactosidase 活性を1としたとき、生薬抽出物を添加することにより、β-galactosidase 活性を70%以上阻害したものは8種類であった(図1)。
●アポトーシス誘導確認 TUNEL染色
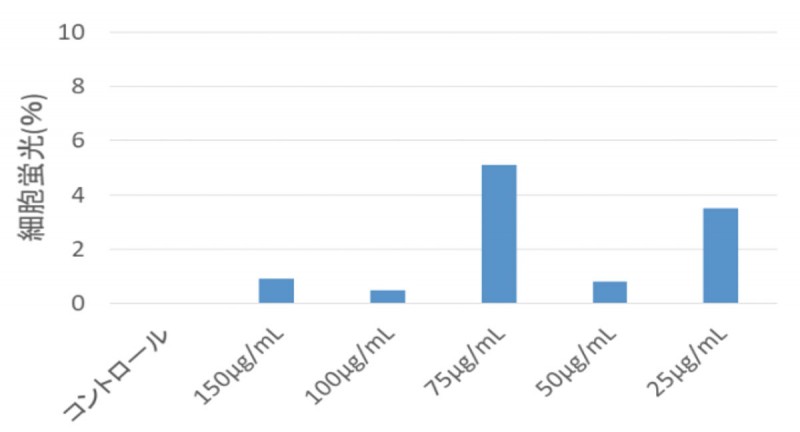
先の結果を基に、効果が見られた生薬(紫根抽出物)をB16メラノーマ細胞に滴下し、アポトーシス誘導の確認を行った(図2)。その結果、コントロールではPIによって0.125%の細胞が染色されていたがTUNELによって蛍光染色されている細胞は存在しなかった。一方、紫根抽出物を添加した細胞ではPIによって染色されている細胞の割合はコントロールと差異がなかったが、TUNEL染色によって蛍光染色されている細胞が確認された。このことから、紫根抽出物にアポトーシス誘導を引き起こす成分が含まれていると考えられた。
構築した酵母ツーハイブリットシステムを用いて、生薬135種類の抽出物に対するスクリーニングを行った。その結果、生薬を添加せずに培養した菌液のβ-galactosidase 活性を1としたとき、生薬抽出物を添加することにより、β-galactosidase 活性を70%以上阻害したものは8種類であった(図1)。
●アポトーシス誘導確認 TUNEL染色
先の結果を基に、効果が見られた生薬(紫根抽出物)をB16メラノーマ細胞に滴下し、アポトーシス誘導の確認を行った(図2)。その結果、コントロールではPIによって0.125%の細胞が染色されていたがTUNELによって蛍光染色されている細胞は存在しなかった。一方、紫根抽出物を添加した細胞ではPIによって染色されている細胞の割合はコントロールと差異がなかったが、TUNEL染色によって蛍光染色されている細胞が確認された。このことから、紫根抽出物にアポトーシス誘導を引き起こす成分が含まれていると考えられた。

-
 指導教員からのコメント
教授 飯田 泰広
指導教員からのコメント
教授 飯田 泰広
- サバイビンは、多くのがんで発現しているタンパク質であり、ある種のタンパク質と結合することにより、がん細胞がアポトーシス(プログラム細胞死)しないようにしている。このサバイビンの機能を抑制すると、そのがん細胞はアポトーシスをすること、通常の細胞はサバイビンをほとんど発現していないことから、副作用の少ない新しい抗がん剤の開発につながると期待できる。本研究では、酵母を用いてサバイビンの機能の抑制を評価できる方法を開発し、実際に機能を抑制できる生薬抽出物の探索を試みた。また、抑制できた生薬抽出物が、がん細胞に対してアポトーシスの誘導を行えることを評価した。
-
 卒業研究学生からの一言
城本 春菜
卒業研究学生からの一言
城本 春菜
- 本学科では、生命科学・生物科学領域のより専門的な学びを通し、生命科学分野における未知なる課題の発見・解決能力を養います。このような課題発見・解決能力を身につけるため、実践的なプログラムが1年次より各種用意されていて、卒業研究に発展させていきます。段階的に進んでいくのがいいと思いました。健康・医療分野に役立つ研究に取り組むことができて、達成感を味わいました。
- 応用バイオ科学部応用バイオ科学科(大学サイト )
- 教員紹介ページ(大学サイト )
- 研究室ナビ(大学サイト)


