卒業研究のご紹介
2020年版
化学・バイオ・栄養系所属学生
ストレスで誘因されるシャペロニン翻訳後修飾と活性調節機構の解析
加賀美 奈音群馬県
大学院応用化学・バイオサイエンス専攻Bコース 博士前期課程 2020年3月修了
(応用バイオ科学部応用バイオ科学科/医生命科学特別専攻 2018年3月卒業)
(応用バイオ科学部応用バイオ科学科/医生命科学特別専攻 2018年3月卒業)
群馬県立沼田女子高等学校出身
研究の目的
真核細胞では、タンパク質のアミノ酸側鎖の1つにリン酸基を結合する翻訳後修飾が、タンパク質の活性調節や細胞に特定の状態変化を引き起こすシグナルとして機能していることがわかっている。しかし、近年では原核生物にもこのような調節機構があることが明らかになってきた。シャペロニンGroELは、細胞内のタンパク質が熱などのストレスで変性した際にそれらを保護し再生する機能を持つタンパク質である。私たちは、細胞への熱ストレスが引き金となり、シャペロニンがリン酸化することを発見したため、特定のタンパクキナーゼによるリン酸化を介した機能制御機構を明らかにすることを目指している。
研究内容や成果等
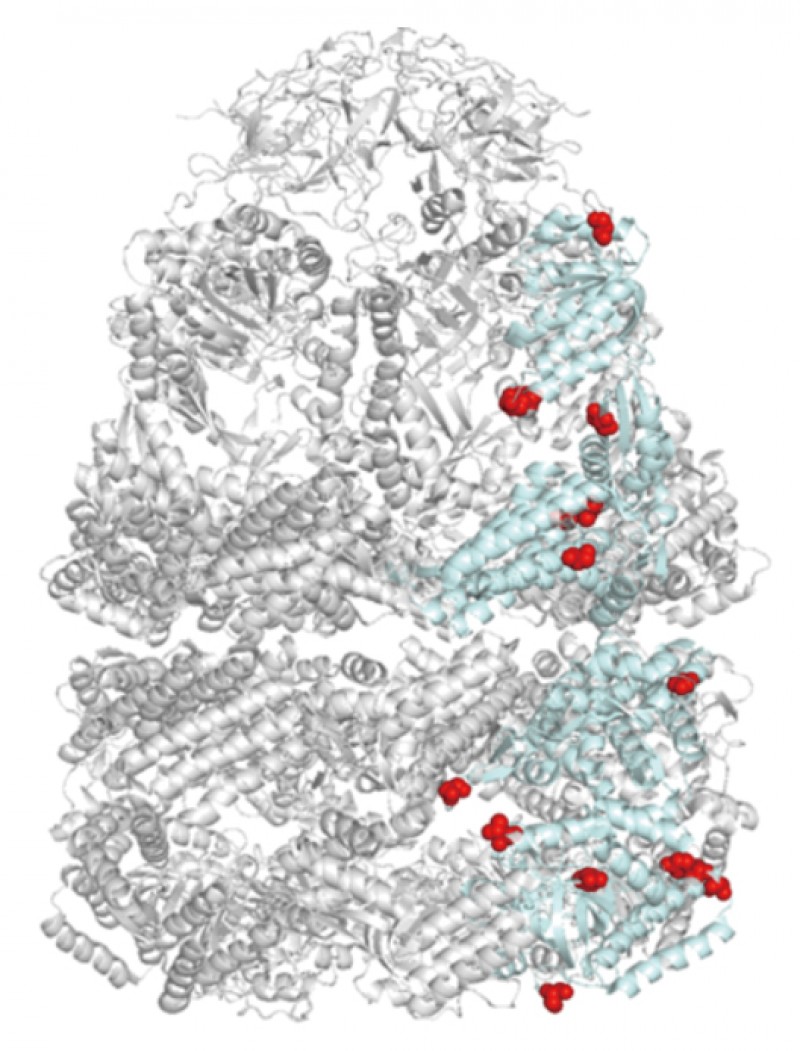
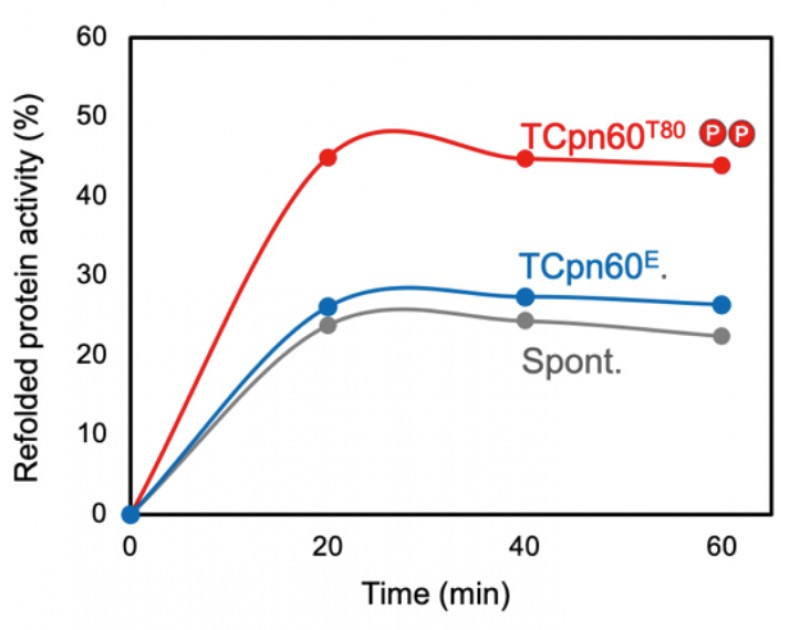
生育温度が70〜75˚Cの高度好熱性細菌Thermus thermophilusを60〜90 ˚Cで培養し、それぞれの菌体からシャペロニン(TCpn60)を精製した。質量分析(LC-MS/MS)を用いてリン酸化部位の検出を行ったところ、60℃で培養したT.thermophilusから精製したTCpn60T60では、リン酸化部位は3ヶ所であったが、80℃で培養したT.thermophilusから精製したTCpn60T80では8ヶ所のリン酸化部位が検出された(図1)。培養温度が高くなるほどリン酸化修飾部位が増えていたことから、T.thermophilusの熱ストレス応答とシャペロニンのリン酸化は関連していると考えられた。T.thermophilusから精製したTCpn60T80 と、組換え大腸菌から精製したTCpn60Eのシャペロニン活性を比較したところ、TCpn60T80はTCpn60Eの5倍の変性タンパク質フォールディング活性を示した(図2)。さらに、T.thermophilusのゲノムにコードされるプロテインキナーゼ遺伝子をクローニングし、組換え大腸菌内でTCpn60とプロテインキナーゼを共発現させた。精製したTCpn60のリン酸化部位を検出することで、どのプロテインキナーゼがTCpn60のどのアミノ酸をリン酸化するのかを解析した。
-
 指導教員からのコメント
分子機能科学研究室教授 小池 あゆみ
指導教員からのコメント
分子機能科学研究室教授 小池 あゆみ
- 外部からのストレスによって細胞が状態変化をした際に、細胞内では、恒常性を維持するために働く多くの生体分子がドミノ倒しのように次々と化学修飾によるスイッチを連鎖して入れていく機構は、生物ならではの複雑で巧みなシステムです。加賀美さんがこの研究テーマに強い興味をもって果敢に取り組んでくれた結果、温度変化で誘導されるリン酸化部位が特定でき、そのうちの一部をリン酸化するタンパクキナーゼも同定できました。複雑なパズルを解き明かしていく研究の醍醐味を、3年間の研究の最後に学生自身が体験している姿をそばで見ていて、これこそが修士課程の魅力だと強く感じました。
-
 修士研究学生からの一言
加賀美 奈音
修士研究学生からの一言
加賀美 奈音
- 研究でタンパク質を扱うため、実験ではスピードと確実性の両方が求められます。もともとスピードには自信がありましたが、目先のことだけ考えて実験を行ったことで、結果的に2倍の時間がかかってしまった経験や、発表準備・後輩指導に予想以上に時間がかかり、うまく計画が進められなかったことがあります。このときに先生から失敗に対しての指導を受け、先を見据えて論理的な思考をもって行動することを意識するようになりました。発展途上ではありますが、思考を変えたことによって以前よりも実験効率は着実に上がったことを感じます。
- 応用バイオ科学部応用バイオ科学科(大学サイト )
- 教員紹介ページ(大学サイト )
- 研究室ナビ(大学サイト)


