卒業研究のご紹介
2020年版
化学・バイオ・栄養系所属学生
細胞内で形成された基質内包シャペロニン複合体の精製方法の検討
丸尾 達也神奈川県
大学院応用化学・バイオサイエンス専攻Bコース 博士前期課程1年
(応用バイオ科学部応用バイオ科学科 2020年3月卒業)
(応用バイオ科学部応用バイオ科学科 2020年3月卒業)
神奈川県立生田高等学校出身
研究の目的
シャペロニンは変性したタンパク質の構造形成を補助するタンパク質で、細胞内の決まった数百の基質を対象としている。シャペロニンに内包された基質を解析する試みは、大腸菌のGroES/GroELやThermus thermophilusのTCpn10/TCpn60で報告があるが、一般的には最初に基質を認識して結合するGroELに基質選択性があると考えられている。一方、多くのウィルスは宿主のGroES/GroELを利用するが、大腸菌に感染するT4ファージはカプシドタンパク質Gp23の構造形成のためにGroESに似たGp31の遺伝子をもつことが知られている。GroES/GroELではGp23が構造形成できないことから、GroESによる基質特異性の例といえる。細胞内のシャペロニンの基質(シャペロニンによって構造形成されるタンパク質)を同定し、シャペロニンの分子認識機構を解明するために、各GroEL/GroESの組合せの基質を内包したシャペロニン複合体を細胞から精製するための実験系構築を行った。
研究内容や成果等
■ 結果および考察
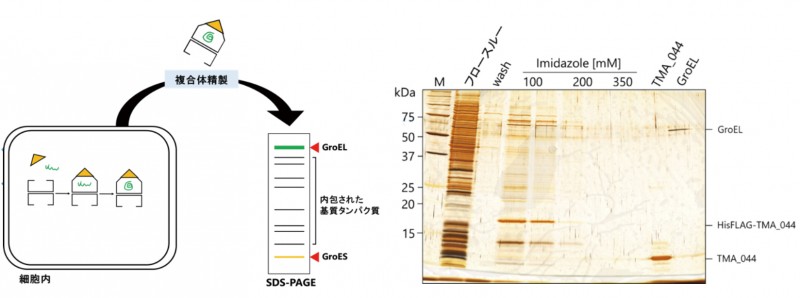
3種類のGroES様タンパク質(GroES、TMA_044、TCpn10)のN末端に精製用ペプチドタグ(His、FLAG)を融合させた発現系ベクターを構築し、組換え大腸菌で発現させた。細胞破砕液から複合体をアフィニティー精製しSDS-PAGEによる解析を行った結果、100mMイミダゾールでの溶出画分でTMA_044のバンドは検出されたが、GroELは検出されなかった。これは、TMA_044とGroEL間の結合強度が弱いため、複合体を維持したまま精製することができなかったと考えられる(図1)。
また、基質内包時間を延長するようアミノ酸に変異を加えた変異型TCpn60D51,396AとTCpn10の共発現系ベクターを構築し、組換え大腸菌で発現させた。3種類のカラムクロマトグラフィーを適用し、TCpn10/TCpn60D51,396A複合体を精製した後、Native-SDS二次元電気泳動による解析を行った。一次元目のNative-PAGEよりTCpn10/TCpn60複合体と思われるバンドが検出され、二次元目のSDS-PAGEより複合体と思われるバンドからTCpn60D51,396A、TCpn10、基質タンパク質と思われるいくつかのスポットが検出されたことから基質タンパク質を閉じ込めた状態の複合体を精製することが出来たと考えられた。
また、基質内包時間を延長するようアミノ酸に変異を加えた変異型TCpn60D51,396AとTCpn10の共発現系ベクターを構築し、組換え大腸菌で発現させた。3種類のカラムクロマトグラフィーを適用し、TCpn10/TCpn60D51,396A複合体を精製した後、Native-SDS二次元電気泳動による解析を行った。一次元目のNative-PAGEよりTCpn10/TCpn60複合体と思われるバンドが検出され、二次元目のSDS-PAGEより複合体と思われるバンドからTCpn60D51,396A、TCpn10、基質タンパク質と思われるいくつかのスポットが検出されたことから基質タンパク質を閉じ込めた状態の複合体を精製することが出来たと考えられた。
-
 指導教員からのコメント
分子機能科学研究室教授 小池 あゆみ
指導教員からのコメント
分子機能科学研究室教授 小池 あゆみ
- 生物が進化の過程でシャペロニンを獲得したことは、遺伝子の変異によってできた『有用な活性をもつが、構造形成が困難で不安定なタンパク質』の利用を可能にし、タンパク質の多様性と、それによる生物の多様な進化を生み出したという学説もあり、本研究は生物の起源にもつながる重要なテーマです。生物が作り上げてきた原理を知るための研究ですが、人工的な工夫を施さないと複合体が不安定で解析が困難な場合に、何をしたら本質をゆがめずに事実を捉えられるのかを考えることが大切です。やりがいのある研究上の難題に正面から向き合い、日々格闘する丸尾君の“ひらめき”に期待しています。
-
 修士研究学生からの一言
丸尾 達也
修士研究学生からの一言
丸尾 達也
- 研究活動を通じて、講義を受け、決められたものを回答すればいいような勉強とは違い、答えがわからない題目に対し、様々な視点から論理的に実験を組み立て、得られたデータを客観的に考察して進めていく研究というものの難しさを実感しました。卒業研究を通して自分がどういった力が弱いのか気付くことができ、それを克服すべく、教授には様々な課題を与えていただきました。そのおかげで自分の弱みを少しでも克服することができたと思います。大学院進学後は自身の成長と共に研究の醍醐味を実感していけるよう、一層の努力をしていきたいです。
- 応用バイオ科学部応用バイオ科学科(大学サイト )
- 教員紹介ページ(大学サイト )
- 研究室ナビ(大学サイト)


