卒業研究のご紹介
2021年版
化学・バイオ系所属学生
TCpn60/TCpn10のリン酸化による構造安定性と反応調節機構の解析
猪俣 舞神奈川県
大学院応用化学・バイオサイエンス専攻Bコース 博士前期課程1年
(応用バイオ科学部応用バイオ科学科医生命科学特別専攻 2021年3月卒業)
(応用バイオ科学部応用バイオ科学科医生命科学特別専攻 2021年3月卒業)
神奈川県立大和高等学校出身
研究の目的
シャペロニンGroEL/GroESは、熱ストレスで発現誘導される熱ショックタンパク質の1つで、細胞内の変性タンパク質を基質として、正しい構造へ再生する機能を担う。大腸菌のGroELは、14量体ダブルリング構造をもち、ATPとGroESの結合を伴って、リング内部に変性タンパク質を取り込んで正しい構造へと折り畳む。Thermus thermophilusのシャペロニン(TCpn60/TCpn10)は、大腸菌のGroEL/GroESと約70%のアミノ酸一致率を有し、立体構造も類似している。当研究室では、60-90℃まで温度を変えて培養したT. thermophilus HB8株からTCpn60を精製し、リン酸化部位を同定した。培養温度が高いほどリン酸化部位は多くなり、80℃培養で8箇所が同定できた(図1)。本研究では、その内の3箇所のリン酸化部位をアラニンに置換した変異体を作製し、アラニン変異体によるATP加水分解活性への影響を検証する。
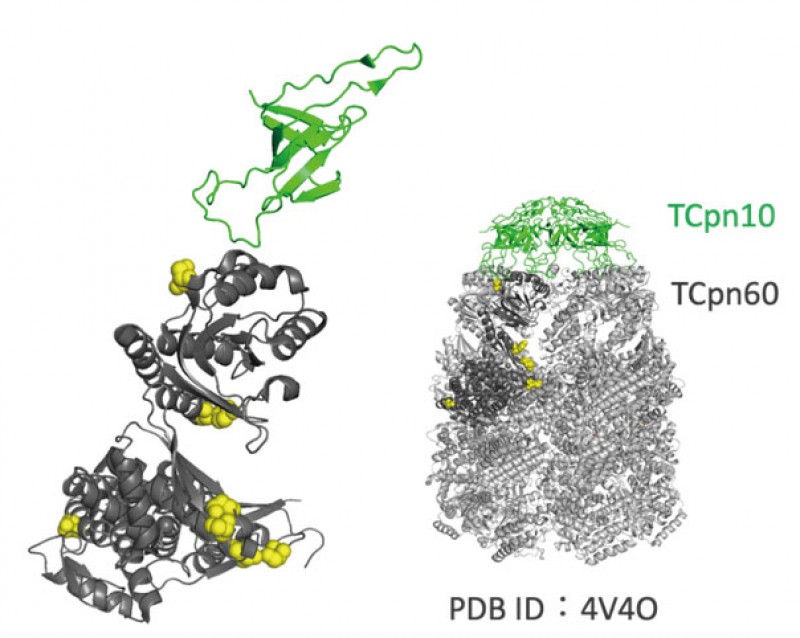
研究内容や成果等
TCpn60のリン酸化部位である内の3箇所をそれぞれ1箇所ずつアラニンに置換するベクターをPCRにて作製した。作製したベクターを大腸菌に形質転換した後、3種類のTCpn60変異体を精製した。TCpn60変異体をHPLCゲルろ過クロマトグラフィーにて解析した結果、14量体TCpn60の溶出時間である約20分の位置にピークが検出された。また、モノマーのTCpn60に相当する約35分の位置にもピークが検出された(図2)。ATP再生法によるATP加水分解活性測定を行なった結果、TCpn60変異体は野生型と同等のATP加水分解活性を保持していることが分かった。また、FoldXプログラムを用いて、リン酸基の有無によるエネルギー変化を、TCpn60のリン酸化部位の内、結晶構造が解かれている7箇所計算した結果、正の値への変化が4箇所、負が1箇所、変化がゼロ付近になるのは2箇所であった。正への変化は複合体構造が不安定化、負への変化は安定化を示すと言われており、今後は複数箇所変異導入した変異体を作製し、活性への影響を見る。
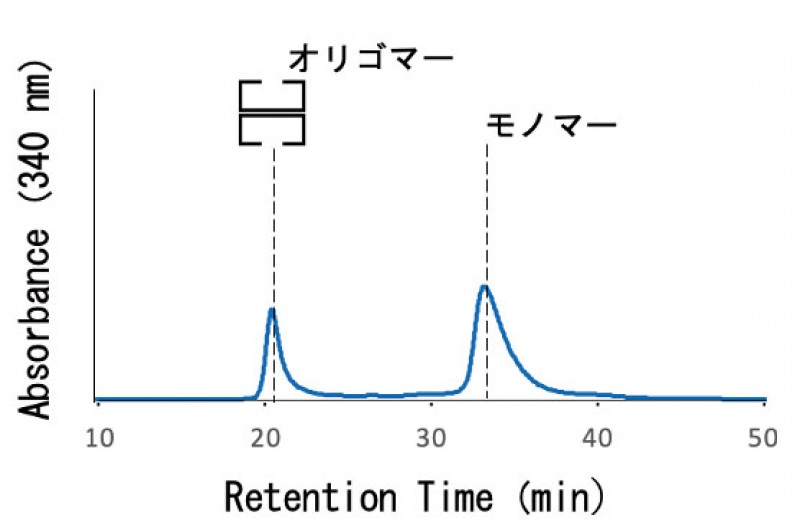
HPLCゲルろ過クロマトグラフィー精製
-
 指導教員からのコメント
分子機能科学研究室教授 小池 あゆみ
指導教員からのコメント
分子機能科学研究室教授 小池 あゆみ
- 細胞外からの刺激(ストレス)が原因で細胞内のタンパク質が化学的な修飾を受け、細胞の状況に応じた適切な活性をもつように制御されているという仕組みは、生物の巧みさを感じます。変性したタンパク質を再生するシャペロニンを、細胞外からのストレスに応答して生物がどのように活性化するのか解明することは、それができないために起こる病気の治療や予防に重要な知見をもたらします。猪俣さんは、例年より増えた自宅学習時間を有効に活用し、生命情報科学からみたリン酸化に伴うタンパク質の結合エネルギーの変化をシミュレーションする新しい手法を卒業研究に果敢に取り入れました。大学院進学後の研究の展開が楽しみです。
-
 卒業研究学生からの一言
猪俣 舞
卒業研究学生からの一言
猪俣 舞
- 私が属していた医生命科学特別専攻では、早期から研究室にて研究活動、講義の中でプレゼンテーションを行う機会が多くあり、卒業研究に着手してこれらの経験は研究を進めるための力になっていることを実感しました。さらに学部最後の1年間の卒業研究活動では、自分の弱点を知り、自分の能力と向き合うことができました。この1年は4年間の中で最も濃厚で、卒業研究だからこそ得られた特別な経験だったと思います。大学院進学後、研究室内ではまた違った立場に立ち、進学したからこそ得られる経験を通じて、自分の能力をさらに成長させたいです。
- 大学院応用化学・バイオサイエンス専攻Bコース 博士前期課程(大学サイト )
- 研究室ナビ(大学サイト)


